 Шадёркина В.А.
Шадёркина В.А.
CEO Uroweb.ru, Москва
Немышечно-инвазивный рак мочевого пузыря (НМИРМП) – это форма рака, при которой опухоль ограничена слизистой или подслизистым слоем мочевого пузыря, не прорастая в мышечную стенку.
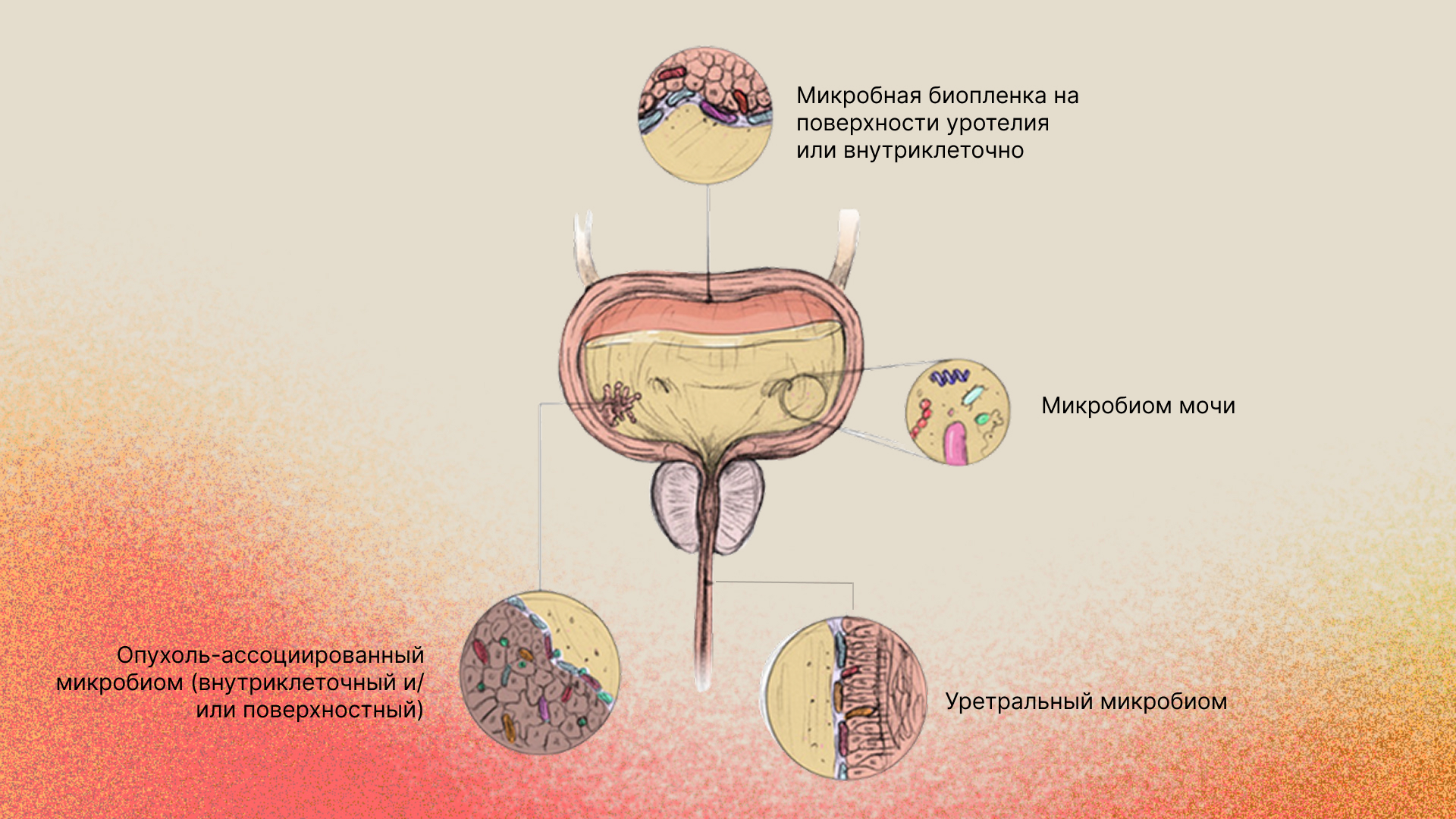
Возможные механизмы канцерогенеза
На долю НМИРМП приходится около 75% новых случаев рака мочевого пузыря [1]. Несмотря на относительно благоприятный прогноз (5-летняя выживаемость достигает почти 90% при своевременном лечении), данное заболевание характеризуется частыми рецидивами (до 50–70% в течение 5 лет) и риском прогрессирования в инвазивные формы (у 10–30% пациентов) [2–4].
Стандартом диагностики и мониторинга остается цистоскопия, однако это инвазивная и дорогостоящая процедура [5]. В этой связи актуален поиск новых неинвазивных биомаркеров, в том числе основанных на анализе мочи.
Долгое время считалось, что мочевыводящие пути стерильны, однако современные исследования опровергли эту догму, обнаружив в моче здоровых людей уникальное сообщество микроорганизмов [6].
Мочевой микробиом – совокупность микроорганизмов, обитающих в мочевых путях, теперь активно изучается в контексте различных заболеваний. Появляются данные, что изменение состава мочевой микрофлоры (дисбиоз) может влиять на развитие и течение рака мочевого пузыря [7, 8].
Хроническое воспаление, поддерживаемое микробами, рассматривается как один из возможных механизмов канцерогенеза [8]. С другой стороны, терапевтическое введение ослабленного живого микобактерии BCG (вакцины БЦЖ) в полость мочевого пузыря – эффективный метод лечения НМИРМП – прямо указывает на то, что иммунная активация микробным агентом способна подавлять рост опухоли [7, 8].
В данном обзоре представлены новейшие научные данные (2018–2025 гг.) о спектре мочевого микробиома при НМИРМП, его типичном составе, отличиях от здоровой нормы, а также о том, какую роль микробиом может играть в развитии, прогрессировании и ответе на лечение рака мочевого пузыря. Отдельно рассмотрены результаты метагеномных исследований (включая секвенирование гена 16S рРНК) и обсуждается диагностическое и прогностическое значение мочевого микробиома.
Состав мочевого микробиома при НМИРМП и отличие от здоровых людей
Диверсификация микробиоты
У пациентов с НМИРМП в моче обнаруживается гораздо более разнообразная микробная флора по сравнению со здоровыми людьми. В ряде исследований показано значительное повышение альфа-разнообразия (числа видов и их равномерности) мочевого микробиома у больных раком [5]. Например, в работе Wu и соавт. (2018) методом секвенирования 16S рРНК было продемонстрировано, что в моче пациентов с раком количество обнаруженных видов в среднем более чем в 2 раза превышает таковое у здоровых (наблюдаемое число OTU: около 120 против 56) [9]. Одновременно отмечено общее различие структуры микробных сообществ (бета-разнообразия) между онкобольными и контролями [9].
Интересно, что некоторые исследования, напротив, не выявили значимой разницы в разнообразии микробиоты между группами [10]. Такая непоследовательность результатов может объясняться различиями в методах отбора проб (самособранная средняя порция мочи против катетеризации и др.) [5].
Тем не менее совокупные данные указывают, что при НМИРМП микробный пейзаж мочи заметно меняется.
Преобладающие таксоны
У больных раком мочевого пузыря отмечено смещение баланса микробиоты в сторону некоторых условно-патогенных бактерий. На уровне типов (фил) в моче пациентов с опухолью обычно повышена доля Proteobacteria и Actinobacteria, тогда как у здоровых превалируют Firmicutes [11, 12].
Так, в моче при раке значимо чаще обнаруживаются представители родов Actinomyces, Achromobacter, Brevibacterium и Brucella [11].
Кроме того, по сравнению со здоровыми контрольными группами у пациентов с раком мочевого пузыря достоверно выше относительное количество ряда известных уропатогенов: Klebsiella, Escherichia (включая шигелл), Pseudomonas, Acinetobacter и др. [10]. К примеру, Acinetobacter фигурирует как «общий знаменатель» сразу в нескольких исследованиях, демонстрируя повышенную численность при раке [10].
Напротив, нормальный мочевой микробиом у здоровых богат бактериями типа Firmicutes, выполняющими защитные функции. В частности, у лиц без рака значительно более выражено присутствие лактобацилл (Lactobacillus) и некоторых анаэробов рода Veillonella [12]. Лактобациллы считаются компонентом здорового урогенитального микробиоценоза, особенно у женщин, и их уменьшенная численность может создавать условия для колонизации патогенами. Действительно, в моче пациентов с НМИРМП лактобациллы зачастую подавлены по сравнению с контролем [1–12].
Различия с контрольной группой
Таким образом, спектр мочевой микрофлоры при НМИРМП сдвинут в сторону повышенного содержания потенциально провоспалительных и условно-патогенных микроорганизмов. Помимо перечисленных, в разных работах отмечалось увеличение доли Staphylococcus, Corynebacterium, Streptococcus, Anaerococcus, Sphingomonas, Prevotella и других родов у больных раком, хотя согласованность по ним ниже [1].
Примечательно, что некоторые бактерии, обычно связанные с мочевыми инфекциями, могут уменьшаться при наличии опухоли. Например, в упомянутом исследовании Wu и соавт. наблюдалось снижение численности Proteus и Serratia в моче больных по сравнению со здоровыми [9]. Авторы связывают это с тем, что в контрольную группу входили пациенты с доброкачественными урологическими проблемами, у которых эти уропатогены встречались чаще.
В целом же, по сравнению со здоровыми людьми, для микробиома мочи больных НМИРМП характерны:
- большее видовое разнообразие;
- повышенная доля типов Proteobacteria и Actinobacteria;
- обогащение рядом грамотрицательных родов (Klebsiella, Escherichia, Pseudo- monas, Acinetobacter, Sphingomonas, Prevotellaи др.) и некоторых грамположительных актиномицетов (Actinomyces и др.);
- относительное снижение ключевых «здоровых» микробов, таких как Lactobacillus.
Эти различия статистически подтверждены во многих исследованиях [13, 14].
Связь микробиома с развитием и прогрессированием рака
Микробиом и канцерогенез
Накоплено множество свидетельств того, что микробы могут способствовать развитию злокачественных опухолей через хроническое воспаление и прямое воздействие на клетки. Применительно к мочевому пузырю считается, что дисбиоз мочевой микрофлоры создает фон воспаления, который поддерживает канцерогенез [5].
Проникновение оппортунистических бактерий в уротелий активирует Toll-подобные рецепторы и каскады воспалительной сигнализации (NF-κB, JAK-STAT), что ведет к выработке цитокинов и формированию хронического воспаления в стенке мочевого пузыря [5].
В опухолевых тканях мочевого пузыря действительно обнаруживаются повышенные уровни провоспалительных цитокинов, таких как IL-6, коррелирующие с худшим прогнозом. Отдельные штаммы бактерий способны вырабатывать генотоксины, напрямую повреждающие ДНК эпителия. Например, известно, что уропатогенные штаммы E. coli могут продуцировать колибактин – токсин, вызывающий повреждение ДНК и тем самым потенцирующий опухолевый рост в кишечнике и, вероятно, в мочевом пузыре [10, 15]. Обнаружение в тканях мочевого пузыря бактериальных биопленок при раке также поддерживает гипотезу об участии микробов в инициации опухоли.
В эпидемиологических исследованиях связь рака мочевого пузыря с перенесенными инфекциями мочевых путей остается противоречивой. Некоторые работы отмечают, что частые инфекции ассоциируются с повышенным риском рака, тогда как другие сообщают об обратном – многократные эпизоды ИМП коррелируют со снижением вероятности развития рака, особенно у женщин.
Метаанализ новейших данных не выявил однозначной связи между анамнезом инфекций и заболеваемостью раком мочевого пузыря. Тем не менее потенциальная роль микробного фактора в инициации опухолевого роста признана.
Прогрессирование и рецидивы
Особый интерес представляет вопрос: влияет ли состав мочевого микробиома на агрессивность опухоли и риск рецидива НМИРМП. Большинство исследований не обнаружили явных отличий микробиоты между поверхност- ными (НМИРМП) и инвазивными (MIBC) формами рака мочевого пузыря на уровне альфа- и бета-разнообразия [10].
Однако отмечены различия в удельном составе отдельных таксонов. Так, у пациентов с мышечно-инвазивным раком (MIBC) в моче обнаруживают больше Haemophilus и Veillonella, тогда как для НМИРМП характерны большие количества Cupriavidus, Staphylococcus, Campylobacter и Corynebacterium [10].
Интересно, что некоторые микробы ассоциированы с риском рецидива: например, Escherichia/Shigella чаще встречалась у пациентов с НМИРМП, не склонным к ранним рецидивам (т. е. при более благоприятном течении). В то же время высокая общая численность и разнообразие микробов, по отдельным данным, скорее сопряжены с большим риском рецидива. В частности, низкое видовое разнообразие мочевого микробиома коррелировало с более продолжительной безрецидивной выживаемостью у пациентов после лечения [5].
Иными словами, чем богаче и сложнее микробное сообщество, тем выше вероятность раннего рецидива опухоли.
«Биомаркеры» прогрессирования РМП
На уровне отдельных бактерий выделены потенциальные «биомаркеры» прогрессирования. Wu и соавт. показали, что у пациентов с группой высокого риска (множественные или крупные опухоли, предполагающие склонность к прогрессированию) мочевой микробиом обогащен особыми родами бактерий – Herbaspirillum, Porphyrobacter и Bacteroides [9].
Эти организмы практически отсутствовали у пациентов низкого риска и у здоровых, поэтому были предложены в качестве прогностических индикаторов худшего исхода.
В недавно опубликованной работе (2025) также предпринята попытка классифицировать пациентов по типам мочевого микробиома – так называемым «уринотипам» [1]. Выделены, например, варианты микробиоты, где доминируют Prevotella или Corynebacterium; такие уринотипы значительно чаще наблюдались при раке и предположительно связаны с более агрессивным течением болезни.
Хотя эти данные нуждаются в дальнейшей валидизации, они указывают, что композиция мочевой микрофлоры может предсказывать вероятность рецидива и прогрессии НМИРМП.
Влияние микробиома на формирование ответа на лечение
Микробиота и эффективность BCG-терапии
Стандартным методом лечения НМИРМП является внутрипузырная иммунотерапия вакциной БЦЖ (Bacillus Calmette–Guérin).
BCG – аттенуированный штамм Mycobacterium bovis вводится в мочевой пузырь с целью стимуляции локального противоопухолевого иммунитета. Однако эффективность BCG варьирует: у части пациентов заболевание рецидивирует, несмотря на терапию. Одно из объяснений – различия индивидуального мочевого микробиома, который может влиять на приживление и иммунную активность BCG.
Ряд исследований проверили связь состава микробиоты с исходами BCG-терапии. По совокупности данных альфа- и бета-разнообразие мочевой микрофлоры у пациентов, отвечающих на BCG, статистически не отличается от такового у резистентных пациентов [10]. Тем не менее выявлены отдельные бактерии, наличие которых ассоциировано с успешным ответом на BCG. В частности, у пациентов-«респондеров» достоверно чаще встречались в моче такие микроорганизмы, как Serratia, Pseudomonas, Brochothrix и Negativicoccus. Эти рода могут каким-то образом синергировать с BCG, усиливая противораковый иммунитет.
Предполагается, что определенные комменсальные бактерии способны блокировать или, наоборот, усиливать действие BCG. Например, известно, что для проникновения в клетки и активации иммунных реакций BCG необходимо связываться с фибронектином и интегриновыми рецепторами уротелия. Если мочевой микробиом уже содержит бактерии, способные конкурировать за эти же участки связывания, они могут снизить эффективность BCG-терапии [10]. Показано, что некоторые условно-патогенные микробы (в теории – те же Staphylococcus или Streptococcus) способны «занимать» рецепторы на поверхности уротелия, тем самым мешая прикреплению BCG и ослабляя вызванное им воспаление.
С другой стороны, ряд бактерий (например, Pseudomonas) способен усиливать местный иммунный ответ и может нефункционально активировать сходные с BCG пути. Эти вопросы активно исследуются, поскольку понимание взаимодействия пробиома и BCG может помочь повысить эффективность терапии.
Пробиотики и профилактика рецидивов
Поскольку некоторые бактерии мочевого микробиома проявляют противовоспалительные свойства, возникла идея использовать пробиотики для влияния на течение заболевания. Особое внимание уделяется лактобациллам как составной части нормальной урогенитальной флоры у женщин.
Экспериментальные модели демонстрируют, что введение Lactobacillus способно замедлять рост опухоли мочевого пузыря у животных [16]. У людей еще в 1990-х гг. отмечено, что пероральный прием пробиотика Lactobacillus casei после ТУР опухоли уменьшает частоту рецидива НМИРМП [9, 17, 18].
Более поздние наблюдения и одно когортное исследование показало, что регулярное употребление ферментированных молочных продуктов, богатых лактобациллами, ассоциировано со снижением риска развития рака мочевого пузыря [19].
Недавно было опубликовано, что применение пробиотических препаратов на основе Lactobacillus достоверно уменьшает вероятность рецидива после радикальной цистэктомии [17].
Совокупно эти данные подтверждают, что обогащение мочевого тракта «полезными» микробами потенциально имеет профилактический и терапевтический эффекты. Пробиотики могут уменьшать воспаление и препятствовать колонизации патогенами, тем самым создавая менее благоприятные условия для возврата опухоли.
Однако необходимы дополнительные рандомизированные исследования для внедрения пробиотической терапии в стандарты ведения НМИРМП.
Метагеномные и 16S-рРНК исследования мочевого микробиома
Приведенные выше сведения о микробном спектре мочи при раке мочевого пузыря основаны главным образом на молекулярно-генетических методах анализа.
16S рРНК секвенирование является «золотым стандартом» для профилирования бактериальных сообществ и широко применялось в рассмотренных работах. ДНК, выделенная из осадка мочи, подвергается ампликонному секвенированию участка гена 16S рибосомной РНК, что позволяет определить таксономический состав даже некультивируемых бактерий.
Например, в исследовании китайской группы (Wu и соавт., 2018) секвенирование 16S-рРНК выявило в моче мужчин с НМИРМП в среднем 120 оперативных таксономических единиц (OTU), тогда как в контрольной группе – лишь около 56 OTU, также ими были определены конкретные различия по родам (Acinetobacter, Anaerococcus, Sphingobacterium повышенное содержание при раке; Serratia, Proteus – сниженное) [9].
Другие работы также подтвердили пригодность 16S-подхода для выявления отличий микробиоты между пациентами и здоровыми. В дополнение к бактериальному профилированию ряд современных исследований применяет метагеномный (shotgun) секвенс всей ДНК и методики метатранскриптомики и метапротеомики, позволяющие охватить и вирусные компоненты и оценить функциональную активность микробиома.
Например, в образцах мочи у пациентов с НМИРМП, помимо бактерий, нередко определяются фрагменты ДНК вирусов (полиомавирус BK, вирусы герпеса и др.), хотя их роль в патогенезе пока неясна [20, 21].
Так, Wu и соавт. (2024) провели комплексный анализ мочи больных раком, сочетая 16S-секвенирование, таргетную метаболомику и цитокиновый профиль [5]. В результате была выявлена связь между определенными бактериями, метаболитами и воспалительными факторами.
Например, повышенное присутствие бактерий из семейства Actinomycetaceae положительно коррелировало с уровнем IL-6 в моче (r = 0,58) на фоне НМИРМП, а сами пациенты имели характерный метаболический «отпечаток» – повышение жирных кислот и продуктов их окисления. После хирургического удаления опухоли микробный состав мочи значимо не изменился, оставаясь сходным с дооперационным (что может говорить о персистенции микробного дисбаланса). Зато уровни некоторых метаболитов (ацилкарнитинов) нормализовались [5].
Такой междисциплинарный подход позволил предложить многофакторную панель биомаркеров (см. ниже) и дал ключ к пониманию метаболических последствий микробного дисбиоза при раке мочевого пузыря.
Таким образом, применение современных методов секвенирования и метагеномного анализа существенно продвинуло наши знания о мочевом микробиоме при НМИРМП и его роли в патогенезе.
Диагностическое значение мочевого микробиома
Выявленные отличия мочевого микробиома между пациентами с раком и здоровыми позволяют рассматривать микробный профиль мочи как потенциальный диагностический маркер.
Несколько исследований последних лет предлагают алгоритмы распознавания рака мочевого пузыря по составу мочевой флоры. Так, Sheng и соавт. (2025) разработали диагностическую панель на основе 12 ключевых родов бактерий (включая Sphingomonas, Anaerococcus, Acinetobacter, Stenotrophomonas, Aeromonas, Novosphingobium и др.), которая определяла наличие рака с высокой точностью (AUC = 0,89 на обучающей выборке и 0,71 – на валидационной).
Авторы также ввели индекс пациента, интегрирующий микробиомные данные (Patient Differentiation Index), позволивший достичь около 78% точности на независимых данных [1].
В другом исследовании была предложена комбинированная панель, включающая бактериальный компонент и показатели мочевого метаболома/иммунитета.
В частности, комбинация Actinomycetaceae (семейство бактерий), уровня арахидоновой кислоты (метаболит) и IL-6 (цитокин) дала выдающиеся результаты: чувствительность 94% и специфичность 100% для диагностики рака мочевого пузыря. Эти показатели превосходят традиционные мочевые маркеры (например, цитология, BTA-тест и др.). Хотя подобные панели пока находятся на этапе исследований, они демонстрируют реальную возможность использования мочевого микробиома в ранней диагностике НМИРМП.
Прогностическое значение мочевого микробиома
Не менее важно и прогностическое значение микробиоты. Как обсуждалось выше, определенные характеристики мочевого микробиома ассоциированы с риском рецидива и прогрессирования опухоли.
Это открывает перспективу использования микробиомных индикаторов для стратификации пациентов по риску. Например, наличие в моче обильного роста Porphyrobacter или Herbaspirillum может сигнализировать о необходимости более тщательного наблюдения из-за повышенной вероятности рецидива.
С другой стороны, доминирование Lactobacillus и низкое общее разнообразие микробов, напротив, может указывать на благоприятный прогноз.
Конечно, до практического применения этих критериев предстоит провести огромное количество исследований, валидировать результаты на больших выборках и стандартизовать методы. Тем не менее уже сейчас мочевой микробиом рассматривается как часть «биомаркерного портрета» пациента с НМИРМП наряду с молекулярно-генетическими показателями опухоли. В будущем профилирование мочевой микрофлоры, вероятно, войдет в комплекс неинвазивных тестов для диагностики и прогнозирования течения рака мочевого пузыря.
Выводы
В последние 5–7 лет исследование мочевого микробиома при немышечно-инвазивном раке мочевого пузыря значительно продвинулось. Показано, что моча пациентов с НМИРМП содержит отличающийся от нормы набор микроорганизмов: повышено разнообразие и доля ряда грамотрицательных условно-патогенных бактерий (Proteobacteria), тогда как «здоровые» симбионты (лактобациллы и др.) угнетены.
Эти микробные сдвиги могут иметь биологические последствия – от активации хронического воспаления и повреждения ДНК уротелия до модуляции местного иммунного ответа.
Состав мочевой микрофлоры коррелирует с клиническим поведением опухоли: выявлены микробные маркеры, условно связанные с риском рецидива и ответом на терапию (например, некоторые бактерии чаще встречаются у пациентов, хорошо отвечающих на БЦЖ).
В то же время пробиотические микроорганизмы, особенно Lactobacillus, вероятно, выполняют протективную роль, что отражается в более низкой заболеваемости и частоте рецидивов при их присутствии. Мочевой микробиом уже показал свою ценность как источник потенциальных биомаркеров: разработаны первые диагностические панели рака мочевого пузыря по микробному составу мочи с высокой чувствительностью и специфичностью.
Однако множество вопросов остается открытыми.
Требуются дальнейшие исследования для выяснения причинно-следственных связей:
- Является ли обнаруженный дисбиоз фактором, способствующим возникновению опухоли, или же он вторичен по отношению к опухолевому процессу?
- Каковы точные механизмы влияния отдельных микробов на клетки мочевого пузыря и иммунную систему?
- Может ли модификация микробиоты (например, пробиотиками или антибиотиками) улучшить исходы лечения НМИРМП?
Для ответа на эти вопросы необходимы как широкомасштабные клинические наблюдения, так и фундаментальные эксперименты. Тем не менее уже ясно, что мочевой микробиом – неотъемлемая часть опухолевого микросреды при раке мочевого пузыря. Его учет способен обогатить наше понимание патогенеза, улучшить стратификацию пациентов и в перспективе привести к новым методам профилактики и терапии этого заболевания.
Литература
- Sheng Z, Liu J, Wang M. et al. Exploring bladder cancer through urinary microbiota: innovative «urinetypes» classification and establishment of a diagnostic model. J Transl Med 2025;23:809. https://doi.org/10.1186/s12967-025-06518-y
- Lopez-Beltran A, Cookson MS, Guercio BJ, Cheng L. Advances in diagnosis and treatment of bladder cancer. 2024. https://doi.org/10.1136/bmj-2023-076743
- Sylvester R, Gontero P, Oddens J, Reply to Stephen B, Williams, Ashish M. Kamat’s Letter to the re: Samantha Cambier, Sylvester RJ, Collette L et al. EORTC Nomograms and Risk Groups for Predicting Recurrence, Progression, and Disease-specific and Overall Survival in Non-Muscle-invasive Stage Ta-T1 Urothelial Bladder Cancer Patients Treated with 1–3 Years of Maintenance Bacillus Calmette-Guerin. Eur Urol 2016;69:60–69. European Urology 2016;69(6):E123-E4. https://doi.org/10.1016/j.eururo.2016.01.055
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021;71(3):209–49. https://doi.org/10.3322/caac.21660
- Wu C, Wei X, Huang Z. et al. Urinary microbiome dysbiosis is associated with an inflammatory environment and perturbed fatty acids metabolism in the pathogenesis of bladder cancer. J Transl Med 2024;22:628. https://doi.org/10.1186/s12967-024-05446-7
- Wolfe AJ, Toh E, Shibata N, et al. Evidence of uncultivated bacteria in the adult female bladder. J Clin Microbiol 2012;50(4):1376–83. https://doi.org/10.1128/JCM.05852-11
- Heidar NA, Bhat TA, Shabir U, Hussein AA. The urinary microbiome and bladder cancer. 2023;13(3):812. https://doi.org/10.3390/life13030812
- Chen MF, Lin PY, Wu CF, Chen WC, Wu CT. IL-6 expression regulates tumorigenicity and correlates with prognosis in bladder cancer. PLoS ONE 2013;8(4):e61901. https://doi.org/10.1371/ journal.pone.0061901
- Wu P, Zhang G, Zhao J, Chen J, Chen Y, Huang W, Zhong J and Zeng J Profiling the Urinary Microbiota in Male Patients With Bladder Cancer in China. Cell. Infect. Microbiol 2018;8:167. https://doi.org/10.3389/fcimb.2018.00167
- Heidar NA, Bhat TA, Shabir U, Hussein AA. The Urinary Microbiome and Bladder Cancer. Life 2023;13(3):812. https://doi.org/10.3390/life13030812
- Hussein AA, Elsayed, AS, Durrani M, Jing Z, Iqbal U, Gomez EC, Singh PK, Liu S, Smith G, Tang L, et al. Investigating the association between the urinary microbiome and bladder cancer: An exploratory study. Oncol 2021;39:370.e9–370.e19.
- Bi H, Tian Y, Song C, Li J, Liu T, Chen Z, Chen C, Huang Y, Zhang Y. Urinary microbiota – a potential biomarker and therapeutic target for bladder cancer. Med Microbiol 2019;68:1471–8.
- Oresta B, Braga D, Lazzeri M, et al. The Microbiome of catheter collected urine in males with bladder cancer according to disease stage. J Urol. 2021;205(1):86–93. https://doi.org/10.1097/JU.0000000000001336
- Zeng J, Zhang G, Chen C, et al. Alterations in urobiome in patients with bladder cancer and implications for clinical outcome: a single-institution study. Front Cell Infect Microbiol 2020;10:555508. https://doi.org/10.3389/fcimb.2020.555508
- Garrett WS. Cancer and the microbiota. Science 2015;348:80–6.
- Bučević Popović V, Šitum M, Chow CE.T, et al. The urinary microbiome associated with bladder cancer. Sci Rep 2018;8:12157. https://doi.org/10.1038/s41598-018-29054-w
- Aso Y, Akaza H, Kotake T, Tsukamoto T, Imai K and Naito S. Preventive effect of a Lactobacillus casei preparation on the recurrence of superficial bladder cancer in a double-blind trial. BLP Stud. Group. Eur Urol 1995;27:104–9. https://doi.org/10.1159/000475138
- Zitvogel L, Daillère R, Roberti MP, Routy B, and Kroemer G. Anticancer effects of the microbiome and its products. Rev Microbiol 2017;15:465–78. https://doi.org/10.1038/nrmicro.2017.44
- Aso Y., Akazan H. Prophylactic effect of a Lactobacillus casei preparation on the recurrence of superficial bladder cancer. BLP Study Group Int 1992;49:125–9.
- Hrbáček J, Hanáček V, Kadlečková D, Cirbusová A, Čermák P, Tachezy R, Zachoval R, Saláková M. Urinary shedding of common DNA viruses and their possible association with bladder cancer: A qPCR-based study. Neoplasma 2023;70:311–8.
- Yao X; Xu Z, Duan C, Zhang Y, Wu X, Wu H, Liu K, Mao X, Li B, Gao Y, et al. Role of human papillomavirus and associated viruses in bladder cancer: An updated review. Med Virol 2023;95:e29088.




 Скачать
Скачать