 Шадёркина В.А.
Шадёркина В.А.
CEO Uroweb.ru, Москва
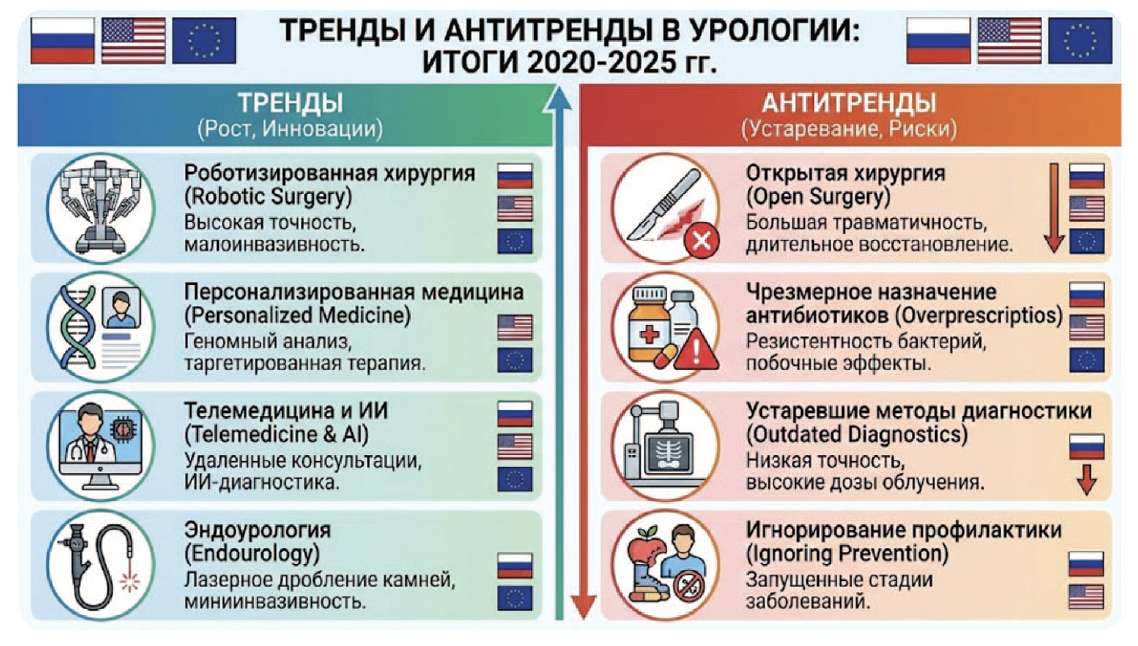
Современная урология в период с 2020 по 2025 год переживает фазу беспрецедентной трансформации, обусловленную синергией трех ключевых факторов: стремительных технологических инноваций, фундаментальных прорывов в молекулярной онкологии и ужесточения стандартов доказательности. Этот период характеризуется не просто появлением новых методов лечения и диагностики, а фундаментальным пересмотром устоявшихся лечебно-диагностических парадигм, что требует от практикующих врачей непрерывного обновления знаний и критической оценки внедряемых практик.
Эволюция урологической практики в эру доказательной медицины
Технологический прогресс выступает основным драйвером изменений. Интеграция роботизированных хирургических систем, усовершенствование лапароскопических и эндоурологических методик, а также внедрение передовых методов визуализации, таких как мультипараметрическая магнитно-резонансная томография (мпМРТ) и позитронно-эмиссионная томография (ПЭТ), кардинально повышают точность диагностики, стадирования и хирургических вмешательств, что напрямую транслируется в улучшение послеоперационных результатов и качества жизни пациентов. Эти инновации позволяют выполнять сложнейшие процедуры с минимальной травматизацией, сокращая время восстановления и снижая риски осложнений.
Параллельно с технологической революцией происходит глубокое переосмысление подходов к лечению, основанное на принципах доказательной медицины.
Ведущие профессиональные сообщества, в первую очередь Европейская ассоциация урологов (European Association of Urology, EAU) и Американская урологическая ассоциация (American Urological Association, AUA), играют центральную роль в этом процессе. Их регулярно обновляемые клинические руководства, основанные на систематическом анализе данных рандомизированных контролируемых исследований (РКИ) и метаанализов, служат основным инструментом для внедрения наиболее эффективных и безопасных практик в повседневную работу уролога. Последние обновления рекомендаций EAU и AUA отражают ключевые сдвиги в лечении уроонкологических заболеваний, мочекаменной болезни, доброкачественной гиперплазии предстательной железы (ДГПЖ) и инфекций мочевыводящих путей.
Цель данного аналитического обзора – предоставить практикующим врачам-урологам структурированный и всесторонний анализ ключевых трендов, определяющих будущее специальности, и антитрендов – подходов, которые теряют свою актуальность или не подтвердили свою эффективность на фоне появления новых, более убедительных научных данных. Отчет сфокусирован на информации, имеющей прямое прикладное значение для клинической практики, и основан исключительно на рецензируемых международных публикациях и клинических руководствах последних пяти лет.
Раздел 1. Онкоурология: смена парадигм в лечении и диагностике
Онкоурология является авангардом изменений в современной урологии. Прогресс в понимании молекулярной биологии опухолей, появление новых классов таргетных и иммунотерапевтических препаратов, а также усовершенствование хирургических и диагностических технологий привели к кардинальному пересмотру стратегий лечения рака предстательной железы, мочевого пузыря и почки.
1.1. Рак предстательной железы (РПЖ)
Рак предстательной железы остается одним из наиболее распространенных злокачественных новообразований у мужчин, и, согласно прогнозам, число новых случаев будет неуклонно расти в ближайшие годы. Несмотря на это, подходы к его ведению претерпели революционные изменения. Произошел фундаментальный сдвиг от парадигмы универсального агрессивного лечения к высоко персонализированной стратегии, в основе которой лежат точная стратификация рисков и приоритет сохранения качества жизни пациента.
Этот сдвиг стал возможен благодаря последовательной цепи технологических и методологических усовершенствований. Изначально, из-за невозможности точно определить агрессивность опухоли и ее локализацию, радикальная простатэктомия считалась стандартом для большинства пациентов. Появление мпМРТ позволило впервые достоверно визуализировать клинически значимые очаги, что, в свою очередь, открыло путь для таргетной биопсии, дающей более точную гистологическую картину по сравнению со слепой системной биопсией. Уверенность в точности диагностики и стратификации риска позволила клиницистам безопасно применять менее агрессивные стратегии, такие как активное наблюдение и фокальная терапия. В результате, качество жизни, а именно сохранение удержания мочи и эректильной функции, превратилось из желаемого побочного результата в одну из центральных целей лечения, сопоставимую по важности с онкологическим контролем.
Тренд №1. Фокальная терапия и активное наблюдение как основные опции при локализованном раке низкого и промежуточного риска
Активное наблюдение (АН) для пациентов с раком низкого риска и фокальная терапия (ФТ) для пациентов с локализованным раком промежуточного риска стали ключевыми трендами, направленными на предотвращение избыточного лечения и его последствий. ФТ представляет собой целенаправленную аблацию только идентифицированного очага клинически значимого рака с сохранением окружающей здоровой ткани простаты. Такой подход позволяет минимизировать риск функциональных осложнений, неизбежно связанных с радикальными методами лечения, такими как радикальная простатэктомия или лучевая терапия.
Данные проспективных исследований и систематических обзоров подтверждают превосходные функциональные результаты ФТ. Например, частота полного удержания мочи после фокальной высокоинтенсивной сфокусированной ультразвуковой аблации (HIFU) достигает 98%, а после фокальной криоаблации – от 95% до 100%. Эректильная функция, достаточная для совершения полового акта, сохраняется у 80% пациентов после фокальной HIFU и у 83,8% после фокальной криотерапии. Онкологические результаты также выглядят многообещающе. В проспективном исследовании II фазы по МРТ-направляемой фокусированной ультразвуковой аблации у пациентов с раком промежуточного риска через 2 года после лечения отсутствие клинически значимого РПЖ в зоне воздействия было подтверждено у 91% участников, а во всей железе – у 84%.
Несмотря на убедительные данные по функциональным и среднесрочным онкологическим исходам, ведущие профессиональные ассоциации, включая AUA и National Comprehensive Cancer Network (NCCN), пока воздерживаются от широкого одобрения ФТ вне рамок клинических исследований. Это связано с необходимостью получения долгосрочных (10-15-летних) данных об онкологической безопасности и сравнения с результатами стандартных методов лечения.
Тренд №2. Усовершенствованный скрининг: роль мпМРТ, геномных тестов и таргетной биопсии
Диагностическая парадигма РПЖ сместилась от «слепой» системной биопсии, основанной исключительно на уровне простат-специфического антигена (ПСА), к риск-стратифицированному подходу с использованием передовых методов визуализации и биомаркеров. Мультипараметрическая МРТ стала ключевым инструментом, позволяющим не только с высокой точностью локализовать подозрительные очаги для последующей таргетной биопсии, но и улучшить стадирование заболевания и отбор пациентов для АН. Метаанализ 2023 года подтвердил, что таргетная биопсия под контролем МРТ оказывает существенное влияние на оценку степени злокачественности по шкале Глисона по сравнению с результатами только системной биопсии.
Внедрение новых биомаркеров в крови и моче дополнительно повышает точность диагностики. Например, комплексный тест STHLM-3, учитывающий несколько белковых маркеров, генетические полиморфизмы и клинические данные, продемонстрировал более высокую прогностическую точность (площадь под кривой AUC = 0,74) по сравнению с одним лишь ПСА (AUC = 0,56) и позволил сократить количество ненужных биопсий на 32%. Руководство AUA рекомендует использовать риск-стратификацию с помощью МРТ и/или биомаркеров перед принятием решения о первичной биопсии, что позволяет избежать инвазивной процедуры у значительной части мужчин.
Тренд №3. Роботизированная простатэктомия (РАРП) как «золотой стандарт» хирургического лечения
В странах с развитой системой здравоохранения роботизированная ассистированная радикальная простатэктомия (РАРП) практически полностью вытеснила открытую методику (ОРП), став де-факто «золотым стандартом» хирургического лечения локализованного РПЖ. Это обусловлено доказанными и воспроизводимыми периоперационными преимуществами, которые включают улучшенную 3D-визуализацию, повышенную точность движений и эргономику для хирурга.
Данные последних метаанализов, обобщающих результаты проспективных исследований и РКИ, убедительно демонстрируют эти преимущества.
Систематический обзор 2023 года показал, что РАРП, по сравнению с ОРП, ассоциируется со значимо меньшим объемом кровопотери (средневзвешенная разница, WMD: -516,59 мл), более низкой частотой гемотрансфузий (отношение шансов, ОШ: 0,23) и сокращением сроков госпитализации (WMD: -1,59 дня).
Метаанализ РКИ 2024 года подтвердил эти выводы, также отметив меньшую общую частоту осложнений при РАРП (ОШ: 0,465). Однако эти преимущества достигаются ценой более длительного времени операции (WMD: +51,41 мин). Важно отметить, что при выполнении операций хирургами с большим опытом, долгосрочные онкологические (частота положительного хирургического края, биохимический рецидив) и функциональные (удержание мочи, эректильная функция через 12-24 месяца) исходы в крупных РКИ и метаанализах оказываются сопоставимыми между РАРП и ОРП.
Таблица 1. Сравнение ключевых исходов роботизированной (РАРП) и открытой (ОРП) радикальной простатэктомии по данным метаанализов (2023-2024)
| Показатель | РАРП | ОРП | Разница (WMD/OR) | p-value |
| Время операции (мин) | Длиннее | Короче | WMD: +51,41 | < 0,0001 |
| Объем кровопотери (мл) | Меньше | Больше | WMD: -516,59 | < 0,00001 |
| Частота гемотрансфузий (%) | Ниже | Выше | OR: 0,23 | < 0,00001 |
| Длительность госпитализации (дни) | Короче | Длиннее | WMD: -1,59 | < 0,00001 |
| Частота осложнений (всех) (%) | Ниже | Выше | OR: 0,465 | 0,0001 |
| Частота положительного хир. края (%) | Сопоставима | Сопоставима | Нет знач. разницы | > 0,05 |
| Удержание мочи через 12 мес. (%) | Сопоставимo | Сопоставимo | Нет знач. разницы | > 0,05 |
| Эректильная функция через 12 мес. (%) | Сопоставима | Сопоставима | Нет знач. разницы | > 0,05 |
WMD – средневзвешенная разница (Weighted Mean Difference); OR – отношение шансов (Odds Ratio).
Антитренд №1. Отказ от универсального ПСА-скрининга в пользу совместного принятия решений (Shared Decision-Making, SDM)
Накопленные данные о вреде гипердиагностики и избыточного лечения клинически незначимого РПЖ привели к полному пересмотру концепции массового ПСА-скрининга. Современная парадигма сместилась от универсального тестирования к индивидуализированному подходу, основанному на совместном принятии решений. Руководство AUA/SUO 2023 года настоятельно рекомендует клиницистам вовлекать пациента в процесс принятия решения о необходимости ПСА-тестирования, подробно обсуждая потенциальные преимущества (снижение смертности от РПЖ) и риски (ненужные биопсии, лечение неагрессивных форм рака и связанные с ним осложнения). Практика рутинного назначения анализа на ПСА без предварительного информирования и согласия пациента признается нежелательной.
Антитренд №2. Ограниченная эффективность комбинаций иммуно- и химиотерапии при мКРРПЖ
В отличие от многих других солидных опухолей, РПЖ оказался относительно «холодной» опухолью, менее чувствительной к иммунотерапии ингибиторами контрольных точек. Попытки улучшить результаты лечения метастатического кастрационно-резистентного РПЖ (мКРРПЖ) путем комбинации иммунотерапии с химиотерапией не увенчались успехом. Метаанализ, результаты которого опубликованы в 2025 году, не выявил статистически значимого преимущества комбинаций ингибиторов PD-1/PD-L1 с доцетакселом по сравнению с монотерапией доцетакселом. Не было отмечено улучшения ни в общей выживаемости (отношение рисков, HR: 0,95), ни в выживаемости без прогрессирования (HR: 0,93), ни в частоте ПСА-ответа.
Эти данные свидетельствуют о том, что данная комбинация не станет стандартом лечения для этой сложной категории пациентов, и требуются новые подходы, возможно, основанные на других механизмах действия.
1.2. Рак мочевого пузыря (РМП)
Лечение метастатического уротелиального рака (мУР) претерпело настоящую революцию с появлением нового класса препаратов – конъюгатов антитело-препарат (ADC). Успех одного ADC и неудача другого продемонстрировали, что будущее уроонкологии зависит не столько от класса препаратов, сколько от глубокого понимания биологии конкретной опухоли и правильного выбора молекулярной мишени. Первоначально ADC рассматривались как универсальная платформа. Успех энфортумаба ведотина, нацеленного на высокоэкспрессированный в УР белок Nectin-4, подтвердил потенциал этого подхода. Однако последующая неудача сацитузумаба говитекана в РКИ III фазы, нацеленного на другую мишень (Trop-2), показала, что сам по себе механизм ADC не гарантирует успеха. Эффективность критически зависит от биологии мишени: ее уровня, гомогенности экспрессии и роли в выживании опухолевых клеток. Этот опыт смещает фокус будущих исследований с разработки новых цитотоксических «боеголовок» на поиск и валидацию более специфичных и надежных антигенных мишеней, что является прямым следствием уроков, извлеченных из сравнительной истории этих двух препаратов.
Тренд №4. Комбинация Энфортумаб Ведотин (EV) + Пембролизумаб – новый стандарт первой линии терапии
Комбинация энфортумаба ведотина (ADC, нацеленный на Nectin-4) и пембролизумаба (ингибитор PD-1) продемонстрировала беспрецедентные результаты, кардинально изменив прогноз для пациентов с мУР и установив новый стандарт первой линии терапии. В ключевом РКИ III фазы EV-302/KEYNOTE-A39 эта комбинация сравнивалась со стандартной химиотерапией на основе препаратов платины. Результаты оказались впечатляющими: медиана общей выживаемости в группе комбинации достигла 31,5-33,8 месяцев по сравнению с 16,1 месяцами в группе химиотерапии (HR смерти около 0,47-0,51). Медиана выживаемости без прогрессирования также практически удвоилась: 12,5 месяцев против 6,3 месяцев (HR прогрессирования около 0,45). На основании этих данных FDA и другие регуляторные органы одобрили комбинацию EV+Пембролизумаб для лечения пациентов с местнораспространенным или метастатическим уротелиальным раком.
Сетевые метаанализы подтвердили, что данный режим значительно превосходит все другие варианты первой линии, включая комбинации химиотерапии с другими ингибиторами контрольных точек (ниволумабом, атезолизумабом), по всем ключевым показателям эффективности.
Тренд №5. Роботизированная цистэктомия (РАРЦ) для улучшения периоперационных исходов
Аналогично простатэктомии, роботический подход при радикальной цистэктомии (РАРЦ) набирает популярность с целью снижения травматичности операции и ускорения восстановления пациентов. Многочисленные метаанализы РКИ и крупных когортных исследований демонстрируют, что РАРЦ, по сравнению с традиционной открытой цистэктомией (ОРЦ), ассоциируется со значимо меньшим объемом интраоперационной кровопотери, более низкой частотой гемотрансфузий и, в ряде исследований, с более коротким сроком госпитализации. Особенно выраженное преимущество в снижении частоты послеоперационных осложнений (на 90 дней) наблюдается при выполнении интракорпорального (полностью роботического) формирования мочевого резервуара (ICUD) по сравнению с экстракорпоральным (ECUD) и открытым подходами.
При этом РАРЦ неизменно требует большего операционного времени. Важнейшим аспектом является то, что долгосрочные онкологические исходы, такие как общая и канцер-специфическая выживаемость, частота рецидивов, количество удаленных лимфатических узлов и частота положительного хирургического края, в большинстве исследований оказываются сопоставимыми между РАРЦ и ОРЦ, что подтверждает онкологическую безопасность роботического подхода.
Антитренд №3. Сацитузумаб Говитекан (SG) – препарат, не подтвердивший свою эффективность
История сацитузумаба говитекана, ADC, нацеленного на антиген Trop-2, является ярким примером антитренда и важности подтверждения результатов II фазы в крупных РКИ III фазы. Первоначально препарат получил ускоренное одобрение FDA на основании многообещающих данных по частоте ответа в исследовании II фазы TROPHY-U-01. Однако в последующем РКИ III фазы TROPiCS-04, где SG сравнивался со стандартной химиотерапией у пациентов, ранее получавших препараты платины и ингибиторы контрольных точек, препарат не достиг своей первичной конечной точки – увеличения общей выживаемости (HR 0,86, p=0,087). Более того, в группе SG была отмечена более высокая токсичность, включая более высокую частоту смертельных исходов, связанных с лечением (7% против 2%). Эти результаты привели к добровольному отзыву производителем показания к применению препарата при РМП в октябре 2024 года. Ретроспективные данные также показывают крайне низкую эффективность SG у пациентов, уже получивших лечение энфортумабом ведотином (медиана ВБП 2,5 мес., медиана ОВ 3,2 мес.), что делает его применение в этой последовательности нецелесообразным.
1.3. Почечно-клеточный рак (ПКР)
Лечение метастатического почечно-клеточного рака (мПКР) полностью трансформировалось с приходом эры иммунотерапии. Успех комбинированных режимов не только значительно увеличил продолжительность жизни пациентов, но и изменил саму цель терапии. Если ранее основной задачей было сдерживание болезни, то теперь для части пациентов с глубокими и длительными ответами на лечение становится реальной цель достижения состояния «нет признаков заболевания». Это, в свою очередь, актуализирует роль локальных методов контроля (хирургия, лучевая терапия, аблация). Прорыв в системной терапии стимулирует переосмысление и расширение показаний к локальным методам: они все чаще применяются не как паллиативные, а как консолидирующие методы для эрадикации остаточных очагов болезни у пациентов с олигометастатическим или олигопрогрессирующим заболеванием после успешной системной терапии.
Тренд №6. Комбинации ICI и TKI как стандарт первой линии
Комбинации ингибиторов иммунных контрольных точек (ICI) с ингибиторами тирозинкиназ (TKI) стали неоспоримым стандартом первой линии терапии метастатического светлоклеточного ПКР, продемонстрировав значительное преимущество в выживаемости по сравнению с ранее стандартной монотерапией TKI (сунитинибом).
Ключевые регистрационные исследования подтвердили высокую эффективность нескольких режимов:
- Ниволумаб + Кабозантиниб (РКИ CheckMate 9ER). Эта комбинация показала удвоение медианы выживаемости без прогрессирования (ВБП) по сравнению с сунитинибом (16,6 мес. против 8,3 мес.; HR 0,51) и значительное улучшение общей выживаемости (ОВ) (HR 0,60).
- Ленватиниб + Пембролизумаб (РКИ KEYNOTE-581/CLEAR). Данный режим продемонстрировал одни из самых впечатляющих результатов по ВБП, достигнув медианы в 23,9 месяцев против 9,2 месяцев для сунитиниба (HR 0,39), а также достоверное увеличение ОВ (HR 0,66).
Эти комбинации стали предпочтительными вариантами первой линии для большинства пациентов, а их применение активно изучается и при несветлоклеточных гистологических подтипах ПКР.
Таблица 2. Эффективность ключевых комбинаций первой линии при метастатическом почечно-клеточном раке (светлоклеточный вариант)
| Режим терапии (РКИ) | Группа сравнения | Медиана ОВ (мес.) | Медиана ВБП (мес.) | ЧОО (%) |
| Ниволумаб + Ипилимумаб (CheckMate 214) | Сунитиниб | 47,0 | 11,6 | 42 |
| Акситиниб + Пембролизумаб (KEYNOTE-426) | Сунитиниб | 45,7 | 15,7 | 60 |
| Ниволумаб + Кабозантиниб (CheckMate 9ER) | Сунитиниб | НД | 16,6 | 56 |
| Ленватиниб + Пембролизумаб (CLEAR) | Сунитиниб | НД | 23,9 | 71 |
ОВ – общая выживаемость; ВБП – выживаемость без прогрессирования; ЧОО – частота объективного ответа; НД – не достигнута
Тренд №7. Нефрон-сберегающие и аблативные технологии при малых образованиях почки
При лечении небольших опухолей почки (стадия cT1a, <4 см) абсолютным приоритетом является сохранение почечной функции. Это достигается за счет отказа от радикальной нефрэктомии в пользу органосохраняющих вмешательств. Руководства AUA рекомендуют резекцию почки (открытую, лапароскопическую или роботизированную) как стандарт лечения. В качестве альтернативы, особенно для опухолей менее 3 см у пациентов с высокой коморбидностью или пожилого возраста, активно применяются аблативные технологии, такие как криоаблация, радиочастотная (РЧА) и микроволновая аблация (МВА).
Эти методы показывают хорошие онкологические результаты при минимальной инвазивности. Даже в случае местного рецидива после первичной аблации, повторные минимально инвазивные вмешательства (повторная аблация или лапароскопическая/роботизированная резекция/нефрэктомия) демонстрируют высокую онкологическую эффективность, достигая контроля над заболеванием в >70% и >98% случаев соответственно.
Раздел 2. Эндоурология и мочекаменная болезнь (МКБ)
Лечение мочекаменной болезни переживает технологический ренессанс, движимый двумя основными трендами: появлением новых, более эффективных источников энергии для литотрипсии и продолжающейся миниатюризацией хирургического доступа.
2.1. Лазерная литотрипсия: тулий против гольмия
Тренд №8. Тулиевый волоконный лазер (TFL) как новый стандарт, превосходящий гольмиевый (Ho:YAG) лазер
Гольмиевый лазер (Ho:YAG) на протяжении десятилетий был «золотым стандартом» в эндоурологии для контактной литотрипсии. Однако появление тулиевого волоконного лазера (TFL) знаменует смену лидера. TFL обладает рядом фундаментальных физических преимуществ: его длина волны имеет в четыре раза более высокий коэффициент поглощения водой, что обеспечивает более эффективную передачу энергии камню и меньшую глубину проникновения в ткани, повышая безопасность. Кроме того, TFL способен работать в режиме сверхвысокой частоты с низкой энергией импульса, что идеально подходит для техники «распыления» камня.
Эти физические свойства транслируются в измеримые клинические преимущества. Метаанализ РКИ, опубликованный в 2024 году, убедительно показал, что по сравнению с Ho:YAG, применение TFL ассоциируется со статистически значимо более высокой частотой полного избавления от камней (stone-free rate, SFR), сокращением общего времени операции и значительно меньшей миграцией (ретропульсией) камней во время процедуры. Другие исследования также отмечают улучшение эндоскопической визуализации во время литотрипсии с TFL.
Переход на TFL является не просто заменой одного инструмента на другой, а катализатором для изменения самой хирургической философии. Традиционная техника с Ho:YAG часто подразумевает фрагментацию камня на несколько крупных частей, которые затем необходимо активно извлекать с помощью эндоскопических корзинок. Этот этап отнимает время и несет риск травмы мочеточника. TFL, благодаря своей уникальной способности эффективно превращать камень в мелкодисперсную пыль, позволяет перейти к стратегии «распылить и оставить выходить самостоятельно». Это снижает потребность в экстракции фрагментов, что, в свою очередь, позволяет использовать уретероскопы еще меньшего диаметра, сокращает общее время операции и потенциально снижает риск ятрогенных повреждений и стриктур мочеточника.
Таблица 3. Сравнительная эффективность тулиевого волоконного (TFL) и гольмиевого (Ho:YAG) лазеров в уретероскопической литотрипсии (по данным метаанализа 2024 г.)
| Показатель | Преимущество TFL | p-value |
| Stone-Free Rate (SFR) | Значимо выше | 0,009 |
| Время операции | Значимо короче | 0,002 |
| Миграция камня (ретропульсия) | Значимо меньше | 0,001 |
| Время работы лазера | Нет значимой разницы | > 0,05 |
| Длительность госпитализации | Нет значимой разницы | > 0,05 |
| Частота осложнений | Нет значимой разницы | > 0,05 |
2.2. Перкутанная нефролитотрипсия (ПНЛ): дальнейшая миниатюризация
Тренд №9. Миниатюризация доступа для снижения травматичности
Стандартная перкутанная нефролитотрипсия (С-ПНЛ) с использованием доступа диаметром 24-30 Fr является высокоэффективным методом лечения крупных камней почки, но сопряжена с риском значимых осложнений, в первую очередь кровотечения. Основным трендом в развитии этого направления стала миниатюризация доступа: Mini-PCNL (14-20 Fr), Ultra-mini-PCNL (UM-PCNL, 11-14 Fr) и Micro-PCNL (<11 Fr). Цель этих методик – снизить травматичность пункционного хода и, как следствие, уменьшить кровопотерю и болевой синдром при сохранении высокой эффективности.
Данные метаанализов подтверждают обоснованность этого подхода. Метаанализ РКИ 2025 года, сравнивавший UM-PCNL и С-ПНЛ для лечения камней размером 1,0-2,5 см, показал сопоставимую частоту полного избавления от камней. При этом UM-PCNL имела явные преимущества в профиле безопасности: более короткий срок госпитализации, меньшее снижение уровня гемоглобина, более низкая общая частота осложнений, включая травму чашечно-лоханочной системы и послеоперационную лихорадку. Аналогичные результаты были получены и для Mini-PCNL при лечении коралловидных камней: метаанализ показал сопоставимый SFR при значимо меньшей потребности в гемотрансфузии и меньшем падении гемоглобина по сравнению со стандартной методикой.
Антитренд №4. Стандартная ПНЛ (24-30 Fr) для камней среднего размера
На фоне доказанных преимуществ миниатюрных методик, применение стандартной ПНЛ для камней среднего размера (1-2,5 см) становится антитрендом. Для этой категории камней мини-перкутанные методики и ретроградная интраренальная хирургия (РИРХ) становятся все более предпочтительными из-за лучшего профиля безопасности. Однако С-ПНЛ сохраняет свою незаменимую нишу и остается методом выбора для очень крупных (>2,5-3 см) и сложных, в том числе коралловидных, камней. При большом объеме камня использование широкого кожуха (24-30 Fr) позволяет быстрее и эффективнее эвакуировать большое количество фрагментов, что обеспечивает более короткое общее время операции по сравнению с мини-методиками.
Развитие ПНЛ идет по пути сегментации: вместо одного универсального метода формируется спектр процедур, выбор между которыми определяется не только размером камня, но и его плотностью, локализацией и анатомией. Это требует от современного эндоуролога владения всем арсеналом методик и способности индивидуально подбирать оптимальную технологию для каждого клинического случая.
Раздел 3. Функциональная урология и доброкачественные заболевания
В этой области урологии основной акцент смещается на сохранение качества жизни, минимизацию побочных эффектов лечения и внедрение стандартизированных, поэтапных подходов к терапии.
3.1. ДГПЖ и симптомы нижних мочевыводящих путей (СНМП)
Тренд №10. Минимально инвазивные хирургические терапии (MISTs) как альтернатива ТУРП
Трансуретральная резекция простаты (ТУРП) долгое время была «золотым стандартом» хирургического лечения ДГПЖ, однако она сопряжена с высоким риском развития ретроградной эякуляции, что неприемлемо для многих сексуально активных мужчин. Рост популярности минимально инвазивных хирургических терапий (MISTs) отражает более широкий социальный тренд: пациенты становятся более информированными и активно участвуют в принятии решений, ставя качество жизни, особенно сексуальную функцию, на один уровень с облегчением симптомов. Это заставляет урологию развивать и предлагать процедуры, которые отвечают этим комплексным запросам, создавая новый сегмент «офисной хирургии ДГПЖ».
MISTs предлагают баланс между клинической эффективностью и минимальным влиянием на сексуальную функцию, занимая нишу между медикаментозной терапией и традиционной хирургией.
- Трансуретральная аблация водяным паром (WVTT, Rezum). Эта методика использует энергию пара для аблации ткани простаты. В руководстве AUA она рекомендована для пациентов с объемом простаты от 30 до 80 г. Пятилетние данные демонстрируют стойкое улучшение симптоматики: снижение балла по шкале IPSS на 48% и улучшение качества жизни (QoL) на 45%. Исследования 2024 года подтвердили эффективность Rezum даже у такой сложной категории пациентов, как больные с хронической задержкой мочи, где 79% из них смогли избавиться от уретрального катетера после процедуры.
- Простатический уретральный лифт (PUL, UroLift). Эта методика заключается в имплантации небольших скоб, которые механически раздвигают доли простаты и открывают просвет уретры без резекции или аблации ткани. Она также является рекомендованной опцией MIST, особенно привлекательной благодаря практически полному отсутствию влияния на эякуляторную функцию.
Таблица 4. Сравнение минимально инвазивных (MIST) и традиционных хирургических методов лечения ДГПЖ
| Метод | Механизм действия | Влияние на IPSS/QoL | Риск ретроградной эякуляции | Риск ЭД de novo | Ограничения по объему предстательной железы |
| WVTT (Rezum) | Термическая аблация паром | Умеренное/ Высокое | Низкий (~4%) | Очень низкий | 30-80 г |
| PUL (UroLift) | Механическое открытие уретры | Умеренное | Практически отсутствует | Очень низкий | < 80-100 г, без средней доли |
| ТУРП | Электрорезекция ткани | Высокое | Очень высокий (60-90%) | Низкий/ Умеренный | < 80-100 г |
| Лазерная энуклеация | Энуклеация аденомы | Очень высокое | Очень высокий (>90%) | Низкий | Практически нет |
Антитренд №5. Устаревшие методики термальной аблации (TUNA, TUMT)
В поправке к руководству AUA по ДГПЖ от 2023 года положения о трансуретральной игольчатой аблации (TUNA) и трансуретральной микроволновой термотерапии (TUMT) были удалены из основных рекомендаций. Эти методики, популярные в прошлом, были вытеснены более современными, эффективными и безопасными MISTs и теперь имеют лишь историческое значение.
3.2. Инфекции мочевыводящих путей (ИМП): новые классификации и акцент на антибиотикорезистентности
Тренд №11. Внедрение новой классификации ИМП и акцент на неантибактериальной профилактике
Глобальная проблема роста антибиотикорезистентности заставляет пересматривать подходы к лечению ИМП. В обновлении руководства EAU по урологическим инфекциям 2025 года анонсировано введение новой, более детализированной системы классификации ИМП.
Ключевым нововведением является добавление отдельного раздела, посвященного неантибактериальным методам лечения и профилактики рецидивирующего цистита. Также обновлены рекомендации по применению иммуномодулирующей профилактики (например, OM-89). Этот тренд отражает глобальный сдвиг от реактивного назначения антибиотиков к проактивной, персонализированной профилактике и использованию альтернативных методов для снижения общей антибиотической нагрузки.
3.3. Недержание мочи и гиперактивный мочевой пузырь (ГМП)
Тренд №12. Строгое соблюдение поэтапного подхода к лечению
Современные руководства, такие как гайдлайн AUA/SUFU по идиопатическому ГМП 2024 года, подчеркивают важность строгого соблюдения поэтапного подхода к лечению. Это позволяет стандартизировать терапию, избежать необоснованного назначения сильнодействующих препаратов и преждевременного использования инвазивных методов.
- Первая линия. Поведенческая терапия остается краеугольным камнем лечения. Она включает тренировку мочевого пузыря, упражнения для мышц тазового дна, коррекцию питьевого режима и диеты.
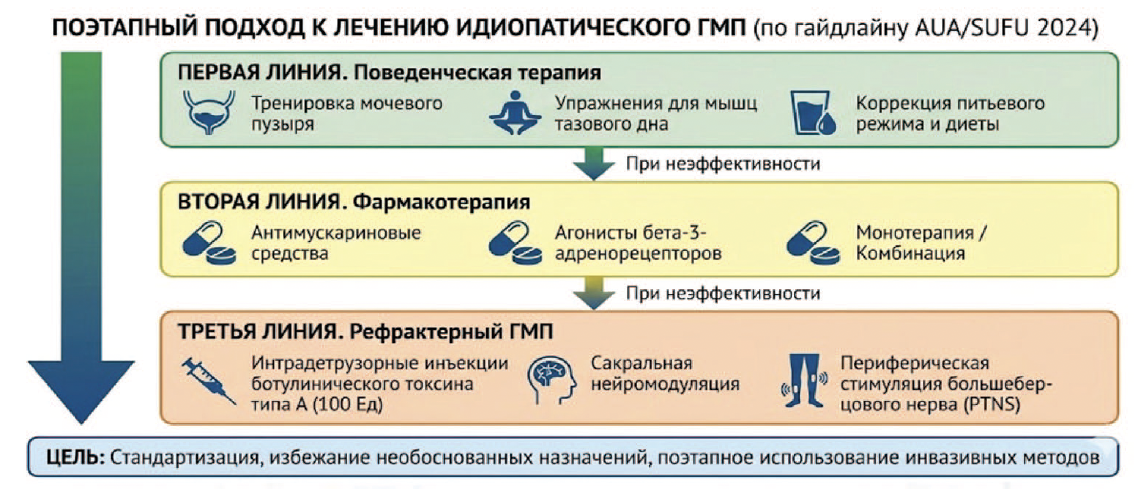
- Вторая линия. При неэффективности первой линии назначается фармакотерапия. Основными классами препаратов являются антимускариновые средства и агонисты бета-3-адренорецепторов, которые могут использоваться как в монотерапии, так и в комбинации.
- Третья линия. Для пациентов с рефрактерным ГМП, не отвечающих на медикаментозное лечение, рекомендованы более инвазивные методы: интрадетрузорные инъекции ботулинического токсина типа А (100 Ед), сакральная нейромодуляция или периферическая стимуляция большеберцового нерва (PTNS).
Раздел 4. Андрология и реконструктивная урология
4.1. Болезнь Пейрони
Тренд №13. Фокус на лечении с доказанной эффективностью
Современный подход к лечению болезни Пейрони строго основан на доказательной базе и фазе заболевания. В острой (воспалительной) фазе, когда присутствует боль, могут применяться нестероидные противовоспалительные препараты, пара-аминобензойная кислота, L-карнитина тартрат. В стабильной фазе, при наличии деформации, мешающей половой жизни, стандартом являются методы с доказанной эффективностью:
- Малоинвазивное лечение. Интралезиональные инъекции коллагеназы Clostridium Histolyticum (CCH) являются единственным одобренным FDA препаратом для лечения болезни Пейрони и предпочтительной малоинвазивной опцией для пациентов с дорсальной и латеральной курватурой от 30 до 90 градусов.
- Хирургическое лечение. Остается «золотым стандартом» для пациентов со стабильной деформацией и/или тяжелой эректильной дисфункцией. В зависимости от степени кривизны, наличия «песочных часов» и сохранности эректильной функции, применяются пликационные операции (операция Несбита и ее модификации), операции с иссечением/рассечением бляшки и графтингом, а также имплантация пенильного протеза.
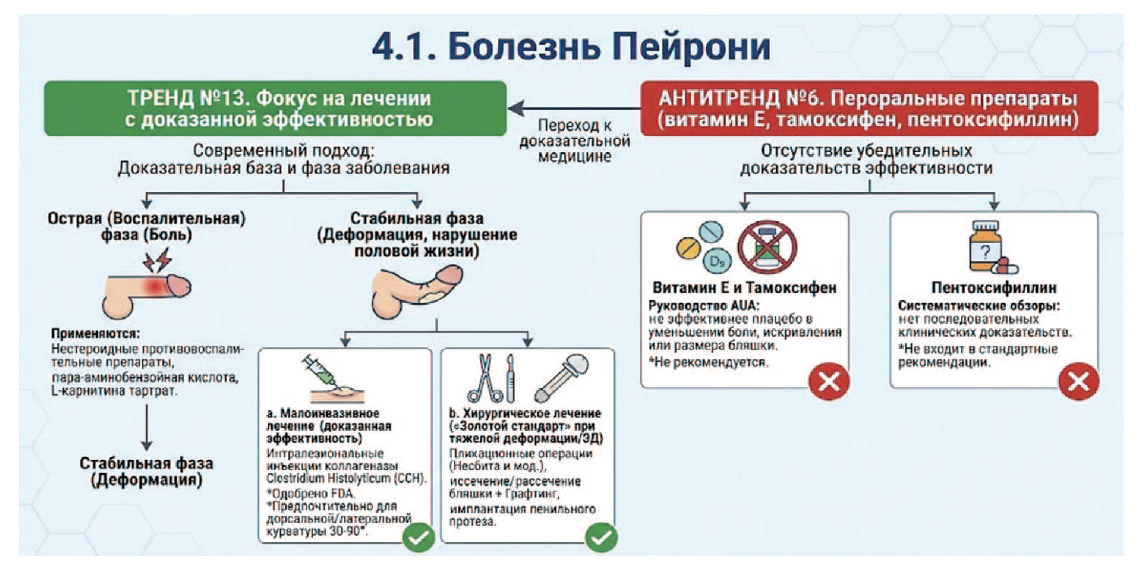
Антитренд №6. Пероральные препараты (витамин Е, тамоксифен, пентоксифиллин)
Несмотря на широкое применение в прошлом, многочисленные пероральные препараты для лечения болезни Пейрони сегодня относятся к категории антитрендов из-за отсутствия убедительных доказательств их эффективности.
- Витамин Е и Тамоксифен. Руководство AUA, основываясь на результатах РКИ, четко указывает, что эти препараты не продемонстрировали преимуществ перед плацебо в отношении уменьшения боли, степени искривления или размера бляшки. Их назначение не рекомендуется.
- Пентоксифиллин. Хотя некоторые доклинические и небольшие клинические исследования указывали на потенциальную пользу пентоксифиллина за счет его антиоксидантного и антифибротического действия, систематические обзоры не смогли найти последовательных и убедительных доказательств его клинической эффективности. В связи с этим он не входит в стандартные рекомендации ведущих урологических ассоциаций.
Взгляд в будущее
Анализ тенденций в урологии за период 2020-2025 годов выявляет несколько доминирующих векторов развития, которые коренным образом меняют клиническую практику.
Эти векторы взаимосвязаны и отражают глобальный тренд на более точную, щадящую и ориентированную на пациента медицину.
- Персонализация. Происходит окончательный отказ от универсальных подходов в пользу высоко стратифицированного лечения. В уроонкологии это проявляется в риск-адаптированном выборе тактики при РПЖ (АН, ФТ или радикальное лечение), использовании молекулярных маркеров для подбора терапии при раке мочевого пузыря и почки. В эндоурологии – в индивидуальном подборе метода литотрипсии (РИРХ, Mini-PCNL, С-ПНЛ) в зависимости от характеристик камня и анатомии пациента.
- Минимальная инвазивность. Роботические и эндоскопические технологии стали стандартом для большинства крупных урологических операций (простатэктомия, цистэктомия, резекция почки). Этот тренд распространяется и на доброкачественные заболевания, где MISTs для лечения ДГПЖ и миниатюризация ПНЛ при МКБ демонстрируют сопоставимую с традиционными методами эффективность при значительно лучшем профиле безопасности.
- Приоритет качества жизни. Функциональные исходы (удержание мочи, эректильная и эякуляторная функции) перестали быть второстепенной задачей и теперь являются одним из ключевых критериев выбора метода лечения, наравне с онкологической эффективностью. Этот тренд наиболее ярко проявляется в росте популярности фокальной терапии РПЖ и MISTs при ДГПЖ.
- Прорывы в фармакотерапии. Появление новых классов препаратов, в первую очередь конъюгатов антитело-препарат (ADC) и комбинированной иммунотерапии, произвело революцию в лечении метастатических форм уротелиального и почечно-клеточного рака, значительно увеличив выживаемость пациентов, ранее считавшихся инкурабельными.
- Повсеместное внедрение ИИ – во все сферы урологии.
Взгляд в ближайшее будущее позволяет предположить, что эти тенденции будут только усиливаться. Ключевую роль в дальнейшем развитии урологии будут играть технологии искусственного интеллекта для анализа медицинских изображений (МРТ, КТ) и гистологических препаратов, что еще больше повысит точность диагностики и прогнозирования. Дальнейшее развитие и удешевление роботических платформ сделает минимально инвазивную хирургию еще более доступной. Наконец, углубление знаний в области геномики и протеомики опухолей откроет путь к созданию следующего поколения таргетных препаратов и по-настоящему персонализированной терапии для каждого пациента. Для практикующего уролога это означает необходимость постоянного обучения, освоения новых технологий и готовности к интеграции сложных диагностических и лечебных алгоритмов в свою повседневную практику.






 Скачать
Скачать